◆材料
1. 生理盐水生理盐水(大塚制药 日本药典 大塚生注食)
2. PMSG(asuka制药 注射血清促性腺激素 动物用性腺激素1000单位/管)
3. hCG(asuka制药 注射用胎盘促性腺激素,动物用性腺激素3000单位/管)
4. 1 mL注射器(泰尔茂株式会社SS-01T2613S)
5. FERTIUP® 精子预孵培养基(Cosmo Bio Co., Ltd)
6. CARD MEDIUM®(Cosmo Bio Co., Ltd)
7. mTHF(Cosmo Bio Co., Ltd)
8. 电动移液器(法国吉尔森电动单道移液器P-200 P-20)
9. 黄色枪头 (BM医疗器 Cat.No.110-96R)
10. 受精用的枪头(Quality Scientific Plastics Pipet Tip Cat.No.114)
11. 流动石蜡(Nacalai Tesque Cat.No.26137-85)
12. 培养皿(Corning 35mm X 10mm Cat.No.430588)
13. 解剖用大剪刀 (夏目制造所 反剪刀 Cat.No.B-2)
14. 解剖用小剪刀 (夏目制造所 小直剪刀Cat.No.B-12)
15. 解剖用大钳子(夏目制造所 无钩尖细的镊子 Cat.No.A-5)
16. 解剖用小钳子 (夏目制造所 尖镊子 Cat.No.A-45)
17. noesu剪刀(森田制造所 电话03-3811-9730 特别订制品)

18. 解剖针(夏目制造所 Broach holderCat.No.E-14)
19. 滤纸
20. 微管
22. 倒置显微镜
23. CO2培养箱
◆方法
过量排卵处理
1. 把激素(PMSG 和hCG) 溶于37单位/mL的生理盐水中
1. * 激素溶液在4°C下,可保存2周
2. 成年雄性小鼠(8~12周龄)需腹腔注射2次,第一次注射PMSG0.2 mL(7.5単位)/只,48小时后,第二次注射hCG 0.2 mL(7.5单位)/只,然后进行过量排卵处理。(通常最好在下午5~6点期间注射激素)
滴液准备
1. 按以下步骤,制作滴液(a、b、c),并静置在二氧化碳培养箱里,令气流稳定。
![2514537122124479.jpg drop[1].jpg](/upfiles/images/201601/2514537122124479.jpg)
a 在解冻精子前30分钟,制作个精子孵育用的培养皿(100 μL FERTIUP® 精子预孵培养基液滴),准备静置在培养箱里;
![2514537122551120.jpg drop_fertiup[1].jpg](/upfiles/images/201601/2514537122551120.jpg)
b 取卵前10分钟,制作受精用培养皿(200 µLCARD MEDIUM滴液1个),静置在培养箱里体外受精时,根据所用精子的不同有不一样的调试方法,详情请参考产品说明书。
![2514537123003277.jpg drop_insemi[1].jpg](/upfiles/images/201601/2514537123003277.jpg)
C 制作清洗卵子用的培养皿(80 µLmHTF滴液4个),在培养箱里静置30中以上
![2514537123181385.jpg drop_wash-mhtf[1].jpg](/upfiles/images/201601/2514537123181385.jpg)
采集精子
用酒精消毒所有的解剖器具
1. 让1~2只成年雄性小鼠(3~6个月龄)安乐死,用大剪刀和大钳子取出附睾管、附睾及一部分脂肪,在滤纸上切除附睾尾及去除血液和脂肪;
2. 把切除的的附睾尾放入精子预孵用培养皿的流动石蜡中;
![2514537123402786.jpg ce[1].jpg](/upfiles/images/201601/2514537123402786.jpg)
3. 用小镊子固定附睾尾,用noesu剪刀切开尾部中央的附睾管;
4. 用解剖针在附睾尾轻压,从附睾管的切开位挤压出精子块;
5. 迅速用解剖针挑出精子块,然后放进FERTIUP® 的精子预孵培养基的滴液里;
*在精子预孵培养皿的滴液里,如精子黏在解剖针的尖端,可用另一根解剖针轻柔地把精子剥离;
6. 把精子注射入FERTIUP® 精子预孵培养基里,放进CO2培养箱里(37°C 5% 二氧化碳 95% 空气)培养60分钟。
![2514537123601182.jpg pickup[1].jpg](/upfiles/images/201601/2514537123601182.jpg)
采集卵子
用酒精消毒所有的解剖器具
1. 让进行了过量排卵处理的雌性小鼠在注射了hCG的15~17个小时后安乐死,取出小鼠的子宫、输卵管、卵巢、及一部
1. 分脂肪,然后在滤纸上切除输卵管的尾部及 去除血液和脂肪;
2. 把输卵管浸入受精用培养皿的流动石蜡中;
![2514537123999085.jpg figure3[1].jpg](/upfiles/images/201601/2514537123999085.jpg)
3. 用镊子把输卵管固定到培养皿底部,用解剖针撕破输卵管壁的胀大部分,把流出的卵子放入CARD MEDIUM 的滴液中。
![2514537124146477.jpg takeoocyte[1].jpg](/upfiles/images/201601/2514537124146477.jpg)
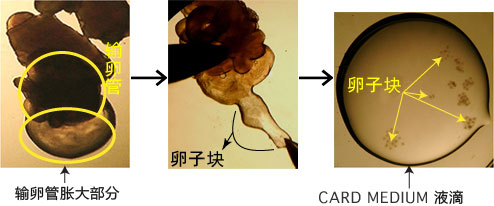
取出的输卵管放置在室温下3分钟以上,卵子的受精能力及生殖能力就会显著下降,因此从雌性小鼠安乐死后到将输卵管取出,再把卵子放入受精用的CARD MEDIUM滴液这一过程要在极短时间内完成(30秒内)。
一个人实验的情况下,请不要一次性安乐死数只雌性小鼠,应该一只只进行,并迅速采集卵子。
一滴CARD MEDIUM里,请引入一只雌性小鼠(两颗)的卵子。
4. 采集卵子后,把受精用培养皿静置在CO2培养箱里进行30~60分钟的培养。
受精
1. 用受精用枪头(Quality Scientific Plastics Pipet Tip Cat.No.114),吸取约6µL预孵的精子悬浊液,然后注射进含有卵子的受精用培养皿的CARD MEDIUM滴液里(进行受精);
2. 将受精用培养皿放在CO2培养箱里进行培养;
![2514537124486122.jpg figure6[1].jpg](/upfiles/images/201601/2514537124486122.jpg)
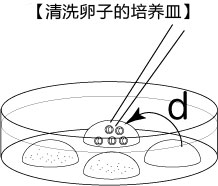
3. 受精3小时后,用玻璃微管吸取形态正常卵子,注射到新的清洗卵子用培养皿的mHTF滴液里,按照(a→b→c)顺序进行洗涤;
* 清洗时,要非常注意在清洗卵子培养皿的滴液上不能混有CARD MEDIUM®
* 清洗前,卵子的透明带表面附着许多精子,使用装有黄色枪头的电动移液器(20μL),在受精用的培养皿的CARD MEDIUM®滴液里移液20~30次后,再清洗卵子。
![2514537124954901.jpg wash1_2[1].jpg](/upfiles/images/201601/2514537124954901.jpg)
4. 受精6个小时后,仔细观察卵子,去取单性生殖卵(卵子细胞内只有1个原核),培养至次日。
![2514537125117707.jpg wash2[1].jpg](/upfiles/images/201601/2514537125117707.jpg)
正常受精卵可见第二极体和雌雄原核(见左图),单性生殖卵里只有一个原核(见右图),未受精卵无法看到原核(见右图)
5. 次日(受精24~28小时后),次日,只把发育到2细胞期的胚胎移到清洗卵子用的培养皿内留下的滴液里,数完胚胎数后,就能将其用于移植或者冻存。
2细胞期胚胎直到囊胚期前都能在体外进行培养 ,在培养时要使用KSOM/AA。
参考文献
【1】 Takeo T., Nakagata N. 2015 Superovulation Using the Combined Administration of Inhibin Antiserum
and Equine Chorionic Gonadotropin Increases the Number of Ovulated Oocytes in C57BL/6 Female Mice. PLoS One.
2015 May 29;10(5):e0128330. doi: 10.1371/journal.pone.0128330.
更新说明
更新 2015.06.01
本实验与使用PMS/hCG进行体外受精的相比,有以下两个不同点。
第一点是在受精用培养皿的CARD MEDIUM滴液中放进两颗未受精卵子;第二点是需要6µL受精用的精子悬浊液。
更新 2015.09.03
注射CARD过量排卵诱导剂的小鼠日龄从24~28日改成25~29日。
注射量由0.2mL改成0.1mL~0.2mL。
更新2015.11.18
把CARD过量排卵诱导剂改写成CARD HyperOva™
用C57BL/6J小鼠进行实验时,发现26~30日龄的小鼠实验效果良好,特此更改注射期。
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |