3D培养和3D支架组织工程研究的有用工具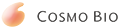
去端肽胶原,蜂窝海绵
Atelocollagen Honeycomb
◆背景
“蜂窝”胶原海绵具有方向统一、均匀的孔(200-400 μm),细胞可以穿透并在其中增殖密集地排列。这种结构有利于营养物质到海绵内为细胞做准备供应,并释放代谢废物和生化产物。细胞能够增殖且填充管腔,形成均匀的细胞团。
去端肽胶原蜂窝海绵 Atelocollagen Honeycomb Sponge (KOU-CSH-10) 为2 mm的立方体,应用于3D细胞 培养物和高密度细胞培养基组织工程细胞支架 |
去端肽胶原蜂窝海绵 Honeycomb Disk 96 (KOU-CSH-96)直径为6 mm圆盘形, 适用于96孔和高通量筛选细胞培养。 |
KOU-CSH-10 : stereoscopic microscope image 立体显微镜图像 |
KOU-CSH-96 : stereoscopic microscope image 立体显微镜图像 |
Electron microscope image of Honeycomb sponge 蜂窝海绵的电子显微图像 |
Electron microscope image of mouse fibroblast cell culture in 'Honeycomb collagen sponge 蜂窝胶原海绵小鼠成纤维细胞培养的电子显微镜图像 |
◆去端肽胶原的特点
去端肽胶原是由蛋白酶溶解的胶原,但是它的物理性质几乎与天然未加溶的胶原蛋白相同。而去端肽胶原更具有优越的特性。
◆特点与优点
“蜂窝”胶原海绵由高度纯化I型去端肽胶原制备(牛皮来源),并且可以通过胶原酶降解。
◆应用
3D培养
组织工程3D支架研究
◆使用实例
实例 1
NG1RGB人成纤维细胞在蜂窝圆盘(KOU-CSH-96)
| 饲养层细胞/孔(×103) | 附着细胞于蜂窝圆盘96(×103) |
10 | 2.2 | |
20 | 5.3 | |
40 | 8.6 | |
细胞增殖:如图所示,在蜂窝圆盘96培养孔中接种。 细胞增殖通过NADH依赖性燃料(WST-8)测定OD值。 | 细胞附着:圆盘培养如图所示,培养一天后转移至新培养孔,并测定细胞数,显示20%的细胞附着。 | |
实例 2
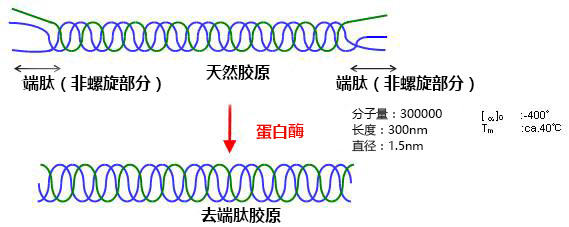
胚体在蜂窝海绵支架体内移植后的胚体致畸移植
小鼠肾脏在海绵蜂窝支架移植(EB/+CSH)胚体移植后12周后,没有形成畸胎瘤的迹象,而无KOU-CSH-10(ES/-CSH)的所有小鼠胚体培养产生畸胎瘤。组织学上,移植ES/+CSH与相邻的主肾组织没有明显区别,表明没有具体的诱导自发分化难以区分。
方法:板中培养小鼠胚胎干(ES)细胞进行胰蛋白酶处理,通过尼龙网过滤,接种到96孔板(1×104 细胞/孔),培养5天,形成胚状体(EB)。当EB与蜂窝海绵(KOU-CSH-10)混合,EB迅速、均匀融入KOU-CSH-10的矩阵中。EB/+CSH复合物移植到6周龄小鼠的肾筋膜。
实例 3
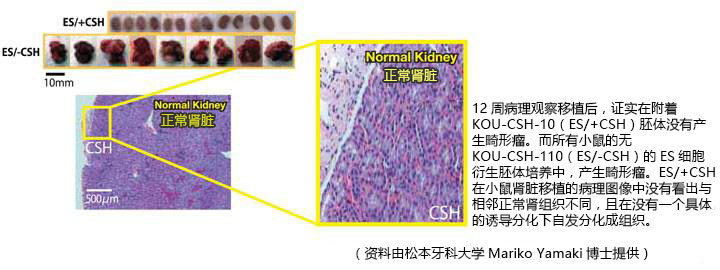
体内小鼠胚胎干/间质细胞镶嵌球移植KOU-CSH-10支架后新生毛发。
方法:小鼠ES细胞和小鼠胚胎间充质细胞(MDU1)共培养以产生两种细胞的镶嵌球体。镶嵌球体与KOU-CSH-10去端肽胶原蜂窝海绵混合,在6周龄小鼠的背部肌肉移植。
<参考文献>
1. Suzuki T, et al. Growth inhibition and differentiation of cultured smooth muscle cells depend on cellular crossbridges across the tubular lumen of type I collagen matrix honeycombs. (2009) Microvasc Res. 77(2):143-149.
◆相关产品
细胞培养胶原:AteloCell
Atelocollagen, Native collagen
去端肽胶原,天然胶原
Atelocollagen powder
去端肽胶原粉末
组织培养胶原溶液是KOKEN(东京)生产的高纯度的胶原溶液,先进的实验室生成,优良的品质控制。
[KOU-IPC-30, KOU-IPC-50, IAC-30, IAC-50, KOU-CLP-01]
Atelocollagen, Eagle's MEM, Hanks' Medium, DMEM
Atelocollagen, Eagle's MEM, DMEM 和 RPMI是用于培养的高纯度胶原溶液。
[KOU-MEN-02, KOU-DME-02, KOU-DME-02H, KOU-RPM-02]
胶原微球用来源于牛皮的I型端肽胶原制备的细胞培养基材。该产品可用于培养,如成纤维细胞,上皮细胞和成骨细胞,并已被证明在细胞培养物的长期维持有效。
[KOU-MIC-00]
Atelocollagen, Honeycomb sponge for cube-shaped and 96-well plate
蜂窝”胶原海绵由高纯度的牛皮来源I型去端肽胶原制备,并且可以通过胶原酶降解。
[KOU-CSH-10, KOU-CSH-96]
Atelocollagen sponge, Collagen sponge for 35mm culture dish and <90 mm×80 mm×5 mm>
去端肽胶原海绵,35 mm培养盘与<90 mm×80 mm×5 mm>胶原海绵
胶原海绵为3D细胞培养开发的一种胶原的产品。
[KOU-CS-35,KOU-CLS-01]
MIGHTY是强力的胶原海绵,即使施加30kPa(单次)的压缩负荷也不会崩溃。
[KOU-CSM-25, KOU-CSM-50]
Atelocollagen, Permeable membrane for 50mm culture dish
去端肽胶原,50 mm培养皿半透膜
Atelocollagen membrane
去端肽胶原膜
胶原膜用高纯度牛皮来源I型去端肽胶原特别制备,用于单层和双层组织培养的研究。
[KOU-MEN-01,KOU-CLF-01]
Atelocollagen, Permeable membrane for 6-well,24-well culture plate, Atelocollagen membrane
去端肽胶原,6孔,24孔培养板,去端肽胶原膜半透膜
由于膜透明,培养时可用显微镜观察细胞。
[KOU-CM-6, KOU-CM-24, KOU-CLF-01]
Type II Collagen II型胶原
Usefull for tissue and cell culture可用于组织和细胞培养[KOU-CL-22]
Atelocollagen coated BETA-TCP scaffold
去端肽胶原涂层BETA-TCP支架
可用于成骨细胞研究[KOU-ACB-05S]
AteloCell® 系列常见问题(FAQ)
AteloCell® 系列非常适合从日常细胞维持到再生医学基础研究的细胞培养

◆脂肪变性胶原海绵 35 mm 培养皿
Q1:胶原蛋白海绵是否耐热? 它能承受的最高温度是多少? 当温度升高到高于体温的温度时,它会降解吗?
A1:我们没有测量这种产品的耐热性。以下信息供您参考,由于液体胶原变性在40°C左右,海绵型胶原可能不会变性,除非达到更高的温度。
Q2:这种胶原蛋白的弹性是什么? 它会容易撕裂吗? 它能承受多少重量? 最重要的是,在处理胶原时,我们应该注意哪些?
A2:我们没有测试这种产品的弹性。然而,它可能抵抗一定水平的负载,因为这种产品是冻干的不溶性胶原蛋白。
Q3:它是否适合移植,例如皮肤移植用于伤口愈合?
A3:这不适合移植,因为是没有消除端肽的天然胶原。
Q4:胶原蛋白海绵会溶解吗? 他们如何溶解? 大概需要多长时间才能使它们完全溶解,特别是移植(如皮肤细胞)到/入动物模型后?
当胶原溶解时,培养的细胞会发生怎么样的变化?
A4:本产品由不溶性胶原蛋白制成,因此不易溶解。在体内情况下,它会在MMP中溶解。虽然该产品不适合移植,但有报道称该产品用于体
内实验。 根据报告,胶原在8周后从活体中移除。移植胶原被认为将可以取代移植细胞的胞外基质,直到其消失。
Q5:我们可以用手术刀手动切割胶原片到更小的尺寸吗? 在切割过程中和切割后会造成胶原片/结构/完整性的破坏/扭曲/分散吗?
A5:你可以切割胶原板,但如果你使用钝刀,孔结构可能会皱起来。
Q6:细胞会以多大强度/完好地吸附到胶原海绵? 即使在强烈搅拌后细胞能否容易分离?
A6:即使在强烈搅拌后,一旦细胞附着,也不容易分离,除非低粘附性细胞。
Q7:我们如何能够以最小损伤从胶原海绵中分离细胞?
A7:请使用胶原酶分离胶原。
◆胶原海绵,90×80×5 mm
Q1:吸水后变形的胶原海绵的厚度是多少?
A1:它将变得略小于5 mm。
Q2:一旦吸收水,海绵将变形,除非进行交联。 这方面的交联是什么意思?
A2:考虑通过UV或γ辐射的物理交联或通过交联剂的化学交联。
Q3:胶原海绵是否耐热? 它能承受的最高温度是多少? 当温度升高到高于体温的温度时,它会降解吗?
A3:我们没有测量这种产品的耐热性。以下信息供您参考,由于液体胶原变性在40°C左右,海绵型胶原可能不会变性,除非达到更高的温度。
Q4:这种胶原蛋白的弹性是什么? 它会容易撕裂吗? 它能承受多少重量? 最重要的是,在处理胶原时,我们应该注意哪些?
A4:我们没有测试这种产品的弹性。然而,它可能抵抗一定水平的负载,因为这种产品是冻干的不溶性胶原蛋白。
Q5:它是否适合移植,例如皮肤移植用于伤口愈合?
A5:这不适合移植,因为是没有消除端肽的天然胶原。
Q6:胶原蛋白海绵会溶解吗? 他们如何溶解? 大概需要多长时间才能使它们完全溶解,特别是移植(如皮肤细胞)到/入动物模型后?
当胶原溶解时,培养的细胞会发生怎么样的变化?
A6:本产品由不溶性胶原蛋白制成,因此不易溶解。在体内情况下,它会在MMP中溶解。虽然该产品不适合移植,但有报道称该产品用于体内
实验。根据报告,胶原在8周后从活体中移除。移植胶原被认为将可以取代移植细胞的胞外基质,直到其消失。
Q7:我们可以用手术刀手动切割胶原片到更小的尺寸吗? 在切割过程中和切割后会造成胶原片/结构/完整性的破坏/扭曲/分散吗?
A7:你可以切割胶原板,但如果你使用钝刀,孔结构可能会皱起来。
Q8:细胞会以多大强度/完好地吸附到胶原海绵? 即使在强烈搅拌后细胞能否容易分离?
A8:即使在强烈搅拌后,一旦细胞附着,也不容易分离,除非低粘附性细胞。
Q9:我们如何能够以最小损伤从胶原海绵中分离细胞?
A9:请使用胶原酶分离胶原。
◆胶原,可渗透膜
Q1:膜是否耐热? 它能承受的最高温度是多少? 当温度升高到高于体温的温度时,它会降解吗?
A1:我们没有测量这种产品的耐热性。以下信息供您参考,由于液体胶原变性在40°C左右,海绵型胶原可能不会变性,除非达到更高的温度。
Q2:膜的弹性是什么? 它会容易撕裂吗? 它能承受多少重量? 最重要的是,在处理膜时,我们应该注意哪些?
A2:我们没有测试这种产品的弹性。然而,它会容易撕裂,因为这种产品被再加工成薄膜形式。
Q3:它是否适合移植,例如皮肤移植用于伤口愈合?
A3:是的。
Q4:渗透膜会溶解吗? 他们如何溶解? 它需要多长时间才能使它们完全溶解,特别是移植(皮肤细胞)到动物模型后?
当胶原溶解时,培养的细胞会发生哪些变化?
A4:我们认为可透膜在移植后约一个月会溶解。
Q5:我们可以用手术刀手动切割膜到更小的尺寸吗? 它会在切割过程中和切割后引起膜结构/完整性的破坏/变形/分散吗?
A5:是的,你可以将膜切成更小的尺寸。
Q6:细胞粘附/附着到可渗透膜上的强度/完整性是什么样的,特别是当我们在膜的双面上进行两种不同细胞类型的夹心培养时?
即使在强烈搅拌后细胞是否容易分离?
A6:即使在强烈搅拌后,一旦它们附着,细胞也不容易分离,除非低粘附性细胞。
Q7:我们如何能够从双侧膜以最小的损伤分离细胞?
A7:请用刮刀或胶原酶回收细胞。
Q8:如何在膜的两个不同表面上观察两种不同的细胞类型? 我们用镊子翻转? 这种行为是否会造成细胞损伤或脱落?
A8:您可以通过相差显微镜观察细胞。然而,难以区分细胞接种于哪一侧。因此,更好的方法是用荧光素标记细胞并通过荧光显微镜观察。
Q9:可以将膜从50 mm培养皿,6孔和24孔培养板上分离下来吗?
A9:可用刀把它分开。
◆胶原,蜂窝海绵
Q1:如何确保培养的细胞粘附在蜂窝海绵上? 我们可以在显微镜下观察吗?
A1:相差显微镜能够观察。
Q2:蜂窝海绵是否耐热? 它能承受的最高温度是多少? 当温度升高到高于体温的温度时,它会降解吗?
A2:我们没有测量这种产品的耐热性。以下信息供您参考,由于液体胶原变性在40°C左右,海绵型胶原可能不会变性,除非达到更高的温度。
Q3:蜂窝海绵的耐久性是什么? 它能承受多少重量?
A3:我们没有测试这种产品的弹性。然而,它会被负载打破,因为这种产品是冻干低浓度胶原。
Q4:蜂窝海绵会溶解吗? 他们如何溶解? 它需要多长时间才能使它们完全溶解,特别是移植(如皮肤细胞)到/入动物模型后?
当蜂窝海绵溶解时,培养细胞会发生哪些变化?
A4:移植后约一个月,海绵会溶解。
Q5:我们可以用手术刀手动切割蜂窝海绵到更小的尺寸(更薄)吗? 在切割过程中和切割后,是否会导致海绵结构的破坏/变形/分散?
A5:你可以切割胶原板,但如果你使用钝刀,孔结构可能会皱起来。
Q6:细胞粘附/附着到蜂窝海绵上的强度/完整性如何?即使在强烈搅拌后细胞是否容易分离?
A6:即使在强烈搅拌后,一旦它们附着,细胞也不容易分离,除非低粘附性细胞。
Q7:可以通过胶原酶处理,简便地收获细胞。处理后会影响细胞活力吗?有何处理方案?
A7:请加胶原酶至终浓度为0.1%,溶解约30分钟。如果你担心细胞损伤,提高胶原酶浓度和减少处理时间。
◆羊毛脂海绵(MIGHTY)
Q1:MIGHTY海绵是否耐热? 它能承受的最高温度是多少? 当温度升高,例如高于体温时,它会降解吗?
A1:我们没有测量这种产品的耐热性。以下信息供您参考,由于液体胶原变性在40°C左右,海绵型胶原可能不会变性,除非达到更高的温度。
Q2:MIGHTY海绵会溶解吗? 他们如何溶解? 它需要多长时间才能使它们完全溶解,特别是移植(如皮肤细胞)到/入动物模型后?
当MIGHTY溶解时,培养的细胞会发生哪些变化?
A2:因为MIGHTY海绵是高强度海绵,它难以溶解。有一个数据表明MIGHTY海绵移植后至少3个月内不会溶解。
Q3:我们可以用手术刀手动切割MIGHTY海绵到更小的尺寸吗? 在切割过程中和切割之后,是否会导致MIGHTY结构的破裂/变形/分散?
在切割过程中是否有任何的推荐步骤或预防措施?
A3:当它是膨胀状态,你可以切割MIGHTY海绵。然而,刀切割海绵后,可能会有切口,因为这是一种高强度的海绵。
Q4:细胞粘附/附着到MIGHTY海绵上的强度/完整性?即使在强烈搅拌后细胞也能很容易分离吗?
A4:即使在强烈搅拌后,一旦它们附着,细胞也不容易分离,除非低粘附性细胞。
Q5:我们如何将细胞以最小损伤从MIGHTY海绵中分离?
A5:因为MIGHTY海绵是高强度的,所以难以从海绵中回收活细胞。另一方面,在均质化之后回收核苷酸或蛋白质是可行的。
◆胶原微球
Q1:微球胶原蛋白的上清液/溶液是什么?
A1:PBS
Q2:如何确保培养的细胞粘附到微球? 我们可以在显微镜下观察吗?
A2:你可以通过相差显微镜观察。
◆胶原涂层B-TCP(B-磷酸钙)支架
Q1:这个支架的厚度是多少?
A1:1.0±0.1 mm
Q2:支架是否耐热? 它能承受的最高温度是多少?当温度升高,例如高于体温时,它会降解吗?
A2:β-TCP支架可以耐高温,但是涂覆的胶原在40℃左右变性。
Q3:支架的弹性如何? 它会容易撕裂/破裂吗? 它能承受多少重量? 最重要的是,在处理胶原时,我们应该注意哪些?
A3:我们没有测试这种产品的弹性。然而,我们认为支架是来自β-TCP,它可以承受一定负载。
Q4:它适合移植吗?
A4:是。 但本产品设计用于骨形成测定。
Q5:支架会溶解吗? 他们如何溶解? 需要多长时间才能使它们完全溶解,特别是移植到动物模型之后?
当支架溶解时,培养的细胞会发生哪些变化?
A5:很难溶解,因为这个产品是由β-TCP组成。
Q6:我们可以用手术刀手动切割支架到更小的尺寸吗? 在切割过程中和切割后会引起支架结构的破坏/变形/分散吗?
A6:很难切割,因为这个产品是由β-TCP组成。
Q7:细胞粘附/附着到支架上的强度/完整性如何?即使在强烈搅拌后细胞是否容易分离?
A7:即使在强烈搅拌后,一旦细胞附着,也不容易分离,除非低粘附性细胞。
Q8:我们如何能够以最小的损害从支架上分离细胞?
A8:请使用胶原酶分离胶原。
Atelocollagen, Honeycomb sponge
Product number : KOU-CSH-10, KOU-CSH-96
<References>
1. | Ishii I, et al. Correlation between antizyme 1 and differentiation of vascular smooth muscle cellscultured in honeycomb-like type-I collagen matrix. Amino Acids. (2012) Feb;42(2-3):565-75. |
2. | Ishii I, et al. Histological and functional analysis of vascular smooth muscle cells in a novel culture system with honeycomb-like structure. At herosclerosis. (2001) Oct;158(2):377-84. |
3. | Mariko Yamaki: in vitro and de novo generation of hair from mosaic spheres formed jointly from ES and mesenchymal cells. The Japanese Society for Regenerative Medicine magazine. (2009)8(2):91-97. |
4. | Mariko Yamaki: Artificial extracellular matrix of type I collagen can suppress the tumorigenetic potential of mouse embryonic stem cells. The Japanese Society for Regenerative Medicine magazine. (2009) 8(1):109-114. |
5. | Suzuki T, et al. Growth inhibition and differentiation of cultured smooth muscle cells depend on cellular crossbridges across the tubular lumen of type I collagen matrix honeycombs. (2009) Microvasc Res. 77(2):143-149. |
6. | Fukui N, et al. Bone tissue reaction of nano-hydroxyapatite/collagen composite at the early stage of implantation. (2008) Biomed Mater Eng. 18(1):25-33. |
7. | Fukushima K, et al. The axonal regeneration across a honeycomb collagen sponge applied to the transected spinal cord. (2008) J Med Dent Sci. 55(1):71-79. |
8. | Kakudo N, et al. Bone tissue engineering using human adipose-derived stem cells and honey comb collagen scaffold. (2008) J Biomed Mater Res A. 84(1):191-197. |
9. | Saeki K, et al. Highly efficient and feeder-free production of subculturable vascular endothelial cells from primate embryonic stem cells.(2008) J Cell Physiol. 217(1):261-280 |
10. | Takeuchi R, et al. Low-intensity pulsed ultrasound activates the phosphatidylinositol 3 kinase/Akt pathway and stimulates the growth of chondrocytes in three-dimensional cultures: a basic science study. (2008) Arthritis Res Ther. 10(4):R77. |
11. | Hidetsugu T, et al. Mechanism of bone inducti on by KUSA/A1 cells using atelocollagen honeycomb scaffold. (2007) J Biomed Sci. 14(2):255-263. |
12. | Rodriguez AP, Missana L, Nagatsuka H, et al.: Efficacy of atelocollagen honeycomb scaffold in bone formation using KUSA/A1 cells. J Biomed Mater Res A. (2006) 77(4):707-717. |
13 | George J, et al. Differentiation of mesenchymal stem cells into osteoblasts on honeycomb collagen scaffolds. (2006) Biotechnol Bioeng. 95(3):404-411. |
14. | Imamura T, et al. Embryonic stem cell-derived embryoid bodies in three-dimensional culture system form hepatocyte-like cells in vitro and in vivo. (2004) Tissue Eng. 10(11-12):1716-1724. |
15. | Itoh H, et al. A honeycomb collagen carrier for cell culture as a tissue engineering scaffold.(2001) Artif Organs. 25(3):213-217. |
16. | Moriyama T, et al. Development of composite cultured oral mucosa utilizing collagen sponge matrix and contracted collagen gel: a preliminary study for clinical applications. (2001) Tissue Eng.7(4):415-427. |
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| KOU-CSH-10 | Atelocollagen Honeycomb sponge | 100 mg | - | - |
| KOU-CSH-96 | Atelocollagen Honeycomb Disc 96 | 25PC | - | - |
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |